In einem nicht gebundenen Wasserstoffatom bewegt sich ein Elektron sehr schnell in der kugelförmigen Hülle um den Atomkern. Die negative Ladung ist ohne scharfe Begrenzung über die ganze Atomhülle verteilt (Elektronenwolke).


Zwei Wasserstoffatome können so zusammentreffen, dass sich die Atomhüllen durchdringen. Die beiden Elektronen befinden sich bevorzugt im Anziehungsbereich beider Kerne, zwischen denen es zu einer Verdichtung der negativen Ladung kommt, und bilden eine gemeinsame Elektronenhülle um beide Kerne. Die negative Ladung dieser Hülle hält beide Atome zusammen.


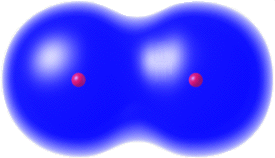

Zwischen den zwei Wasserstoffatomen besteht eine Atombindung (Elektronenpaarbindung). Damit hat jedes der beiden Wasserstoffatome eine stabile Elektronenanordnung, denn die erste Elektonenschale ist mit zwei Elektronen maximal besetzt.

Die beiden Elektronen, die diese Bindung bewirken, bezeichnet man als bindendes Elektronenpaar.
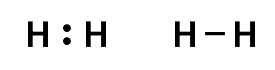
In der Elektronenschreibweise wird das bindende Elektronenpaar durch zwei Punkte oder einen Strich zwischen den Elementsymbolen angegeben.

