
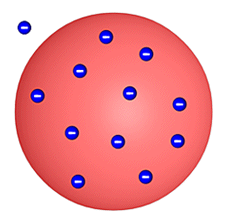
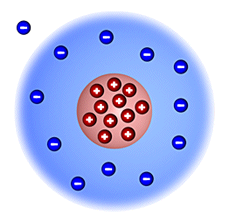
Chemische Elemente bestehen aus nur einer Art von Atomen. Es gibt genau so viele Atomsorten wie chemi- sche Elemente.
Um sich atomare Vorgänge besser veranschaulichen und sie damit besser verstehen zu können, verwendet man Modelle von Atomen.




Ernst Klett Verlag GmbH
Rotebühlstraße 77
70178 Stuttgart
Ansprechpartner:
Markus Hanselmann
Autoren/Mitarbeit
Dr. Norbert Welsch et al., Welsch & Partner, Tübingen
Softwareentwicklung, Animationen und Grafiken
Welsch & Partner, Tübingen

© Ernst Klett Verlag GmbH, Stuttgart 2014
Alle Rechte vorbehalten
Internetadresse: www.klett.de
Das Werk und seine Teile sind urheberrechtlich geschützt. Das gleiche gilt für das Programm sowie das Begleitmatenal. Jede Nutzung in anderen als den gesetzlich zugelassenen Fällen bedarf der vorherigen schriftlichen Einwilligung des Verlages. Hinweis zu
§ 52 a UrhG: Weder das Werk noch seine Teile dürfen ohne eine solche Einwilligung überspielt, gespeichert und in ein Netzwerk eingestellt werden. Dies gilt auch für Intranets von Schulen und sonstigen Bildungseinrichtungen.
Bildquellennachweis
Ernst Klett Verlag GmbH, Stuttgart (Archiv) oder gemeinfrei
Nicht in allen Fällen war es uns möglich, den uns bekannten Rechteinhaber ausfindig zu machen. Berechtigte Ansprüche werden selbstverständlich im Rahmen der üblichen Vereinbarungen abgegolten.
Kompatibel mit folgenden Browsern:
Google™ Chrome (>= 7), Mozilla™ FireFox (>= 9.x), Safari (>= 6.x), Opera (>= 12.x), Microsoft™ IE (>= 9.x)
Diese Anwendung erfordert Javascript. Bitte überprüfen Sie gegebenenfalls ihre Browsereinstellungen.
Minimale Bildschirmauflösung: 1024 x 768 Pixel
Umschalten in Vollbildmodus mit Taste [F11]